【生物3D打印】 “生物医用材料研发与组织器官修复替代”重点专项2016年度申报指南
随着生命科学、材料科学及物理、化学等学科的发展,特别是组织工程技术的发展,推动人体组织器官的修复替代进入了一个崭新的阶段。在我国人口老龄化的加速演进的新形势下,加快研发生物医用材料和组织工程技术及产品,对于培育我国战略新兴产业,转变经济发展方式,实现科技惠及民生具有重要战略意义。为此,科技部日前发布了《生物医用材料研发与组织器官修复替代重点专项2016年度项目申报指南》。详参:http://www.most.gov.cn/tztg/201603/t20160308_124542.htm

该专项旨在面向国家保障全民基本医疗保健和转变发展方式对生物医用材料的重大战略需求,把握生物医用材料科学与产业发展趋势和前沿,抢抓生物医用材料革命性变革的重大机遇,充分利用我国生物医用材料科学与工程研究方面的基础和优势,以新型生物医用材料和植入器械、高值医用耗材为重点,构建我国新一代生物医用材料产业体系,引领生物医用材料产业技术进步,培育一批具有国际竞争力的高集中度多元化生产的龙头企业以及创新团队,为我国生物医用材料产业跻身国际先进行列奠定科学与技术基础。
1. 前沿科学及基础创新
1.1 材料诱导组织形成的机制和理论基础
1.2 材料表面/界面及表面改性研究
2. 关键核心技术
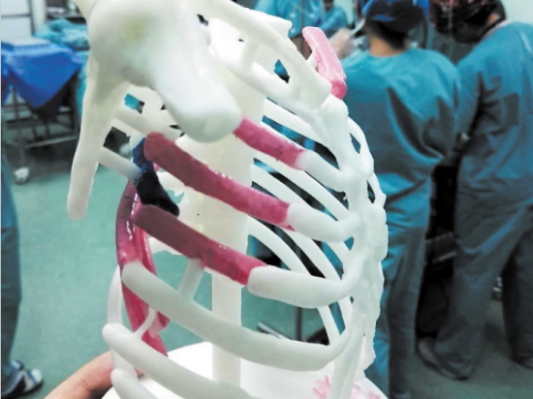
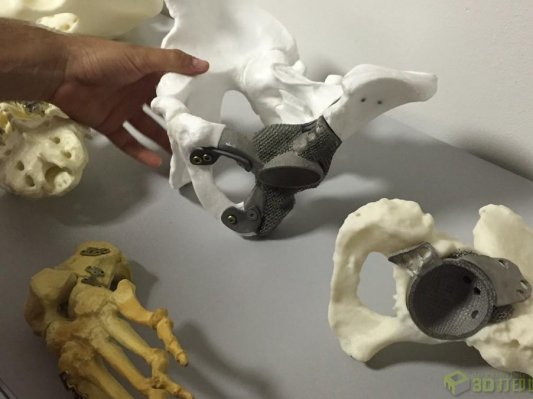
2.1 个性化植、介入器械的快速成型及生物3D打印技术
2.1.1 个性化植、介入器械的快速成型与3D打印
研究内容:研究不含活体细胞的生物相容个性化骨、牙、关节、心血管系统和其他软组织植入器械的快速成型制造(CAD/CAM)及3D打印设备、原材料、软件及其集成;研究具有生物功能的3D打印构架设计、原材料研发、设备及其集成;制定设备及相关制品标准等。
考核指标:提供不少于3种具有自主知识产权的个性化生物相容性植入器械(颅颌面骨、牙冠、关节、盆骨、管腔等)快速成型(CAD/CAM)及3D打印设备、原材料和专用设计软件及其集成,打印精度小于2微米,其中3种以上设备获得CFDA产品注册证,相关植入器械应用于临床;利用研发的技术和设备,构建2种以上具有生物功能(生物活性、组织诱导性、抗凝血性等)的3D打印构架,并进入临床试验或取得CFDA产品注册证(至少有1个产品注册证);核心技术获得国际和国内发明专利不少于6项(国际专利不少于2项)。
支持年限:2016-2020年。
拟支持项目数:1-2项。
有关说明:要求产、学、研、医联合申报,其他经费(包括地方财政经费、单位出资及社会渠道资金等)与中央财政经费比例不低于2:1。
2.2 可降解及智能生物材料和植入器械制备技术
2.2.1 可降解高分子材料及植入器械制备技术
2.3 天然生物材料和组织免疫原性消除技术
2.3.1 动物源组织或器官免疫原性消除及防钙化技术
2.4 组织工程技术
2.4.1 复杂组织构建的工程化技术
2.4.2 器官构建的工程化技术
3. 产品开发
3.1 组织诱导性生物材料及植入器械
3.1.1 中枢神经再生材料和植入器械
3.1.2 周围神经再生材料和植入器械
3.2 高值骨科材料及骨修复替代器械研发
3.2.1 新型人工关节
3.2.2 生物活性脊柱及节段骨缺损修复器械
3.3 心脑血管植、介入材料和器械
3.3.1 具有血管组织修复功能的新一代全降解聚合物支架
3.3.2 全降解金属与合金冠脉血管支架
3.4 口腔植入材料及器械研发
3.4.1 新型牙种植体
3.4.2 个性化颌面部软、硬组织修复材料
3.5 血液净化材料和体外循环系统或人工器官
3.5.1 血液透析材料及体外循环设备
4. 标准及技术规范研究
研究内容:新一代生物材料(组织诱导性材料、组织工程化支架及产品等)检验和评价的基础科学研究。材料和产品的免疫原性、纳米生物特性、组织工程支架与细胞相容性等生物相容性评价的新方法研究,以及探索评价新一代生物材料安全性和可靠性的分子标记,形成国家标准和行业标准建议。研究新型植入器械的生物力学与耐久性检测与评价方法;研究包括植入性生物芯片等体内跟踪植入体的新方法。研究并形成生物3D打印、纳米材料、组织工程等产品的系列标准建议。
考核指标:协助制定15-25个生物材料新产品技术要求,并开展新检验方法的研究。制定新材料、检验方法系列化行业、国家标准建议或标准指南20项以上,包括具有组织诱导性、表面改性等新材料和3D打印、纳米材料、组织工程化产品、新型植入器械等领域的新产品标准10-15项,先进检验和评价方法标准5-10项;制定管理标准和其它技术文件5项以上。
支持年限:2016-2020年。
拟支持项目数:1-2项。
有关说明:要求专业单位牵头,鼓励产、学、研联合申报,其他经费(包括地方财政经费、单位出资及社会渠道资金等)与中央财政经费比例不低于2:1。
“生物医用材料研发与组织器官修复替代”重点专项
2016年项目指南编制专家名单

申报要求
1. 本专项所有项目均应整体申报,须覆盖全部考核指标。每个项目下设课题不超过5个,每个项目所含单位数不超过10家
2. 申报单位和个人必须签署具有法律约束力的协议,承诺各领域项目产生的所有科学数据无条件、按期递交到科技部指定的平台,在专项约定的条件下对专项各承担单位,乃至今后面向所有的科技工作者和公众开放共享。如不签署数据递交协议,则不具备承担专项项目的资格;签署数据递交协议后而不在商定的;期限内履行数据递交责任的,则由专项责令整改;拒绝整改者,则由专项追回项目资金,并予以通报。
3. 本专项研究涉及人类遗传资源采集、收集、买卖、出口、出境等须遵照《人类遗传资源管理暂行办法》相关规定执行。涉及实验动物和动物实验,要遵守国家实验动物管理的法律、法规、技术标准及有关规定,使用合格实验动物,在合格设施内进行动物实验,保证实验过程合法,实验结果真实、有效,并通过实验动物福利和伦理审查。
《3D打印世界》——中国3D打印行业第一本专业月刊(点击可在线阅读)
搜索官方微信账号:“3D打印世界”,新鲜、有料、深度3D打印资讯,尽在3D打印世界!